- ●ウニの原腸陥入が植物極側の細胞内Fアクチン分布の極性により駆動されること、この極性がH+/K+ポンプによる細胞内pH調節により制御されていることを見出し、更にこの極性の乱れが、腸の露出した「外腸胚」形成を促すことを見出しました。
研究の概要
広島大学大学院統合生命科学研究科の粟津暁紀准教授、坂本尚昭准教授、同大学大学院博士後期学生の渡辺開智らのグループは、あらゆる動物の形態形成の初期段階に起こる重要な過程である「原腸陥入」を駆動する力とその制御機序を、ウニを用いた実験と数理モデルにより解明しました。
本研究ではまず、オメプラゾールと呼ばれる薬剤で処理されたウニ初期胚が、原腸が部分的に外に飛び出した「外腸胚」を形成することを見出しました。そこで薬剤処理胚と正常胚の細胞骨格および細胞内pHを蛍光顕微鏡観察したところ、正常胚では植物極側の細胞内Fアクチン分布及びpHに明確なApical-basal極性が形成されているのに対し、薬剤処理胚ではその極性が乱れることが見出されました。そこで各細胞が細胞内分子極性に依存した形状に変形すると仮定した数理モデルのシミュレーションをしたところ、正常胚では原腸が陥入するように胚全体が変形するのに対し、薬剤処理胚では外腸形成を促すように胚全体が変形することを見出しました。
本研究の成果は日本時間の2022年4月9日「Genes to Cells」オンライン版に掲載されました。
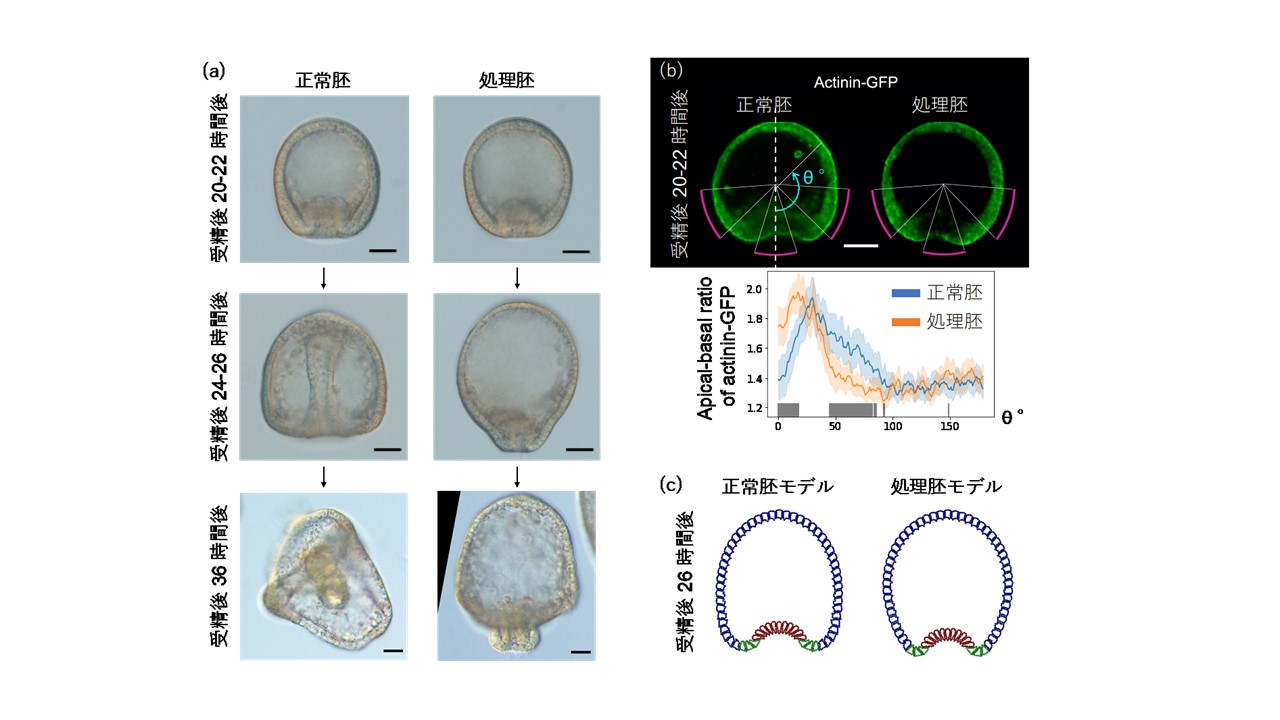
図1. (a) 正常な海水で飼育されたウニ胚(正常胚)、及びオメプラゾールを溶かした海水で飼育されたウニ胚(処理胚)の原腸形成時期の胚の様子。処理胚では原腸が胚の内部に陥入できず、最終的に腸の大部分が外に飛び出した「外腸」が形成される。(b) 陥入開始時期の細胞内Fアクチンマーカー(Actinin-GFP)の蛍光顕微鏡画像(上)とそのApical-basal極性の強度分布(下)。この段階では、正常胚と処理胚での間に胚の形状の違いは見られないが、植物極側(特にマゼンタの曲線の部分)の細胞で、処理胚の細胞内Fアクチン分布のApical-basal極性が正常胚から有意に大きくずれている。(c) 各細胞の形状が、FアクチンのApical-basal極性の強度に依存して変形すると仮定した数理モデルのシミュレーション結果。正常胚モデルでは植物極側の細胞の外側が大きく広がり丸みを帯びた形状になるのに対し、処理胚モデルでは実験同様、植物極側の丸みが失われ、胚全体が縦に間延びした形状になる様子が見られた。
発表内容
【研究の背景】
動物と分類されるほとんどの生物は、受精・卵割後の初期発生段階において、原腸陥入と呼ばれる胚大域的な形態変化を経て、出入口のない球型から消化器系を備えたドーナツ型の体を獲得します。このトポロジー変化を伴う変化は、胚全体の各細胞が適切な場所・タイミングで移動・変形・分裂等の各々の役割を全うすることで可能になる、全員参加型の協同的動態として進行します。
本研究ではヒトを含む後口動物の祖先型で、動物の初期発生・形態形成研究のモデル生物であるウニの原腸陥入に着目しました。ウニはその初期胚発生の様子が高校の生物の授業の資料などでも取り上げられているように、原腸陥入の全過程を容易に明確に観察することができます(図1)。しかしそのようなウニ胚でさえ、この胚大域的な協同運動がどのように駆動・制御されているのか、十分にはわかっていませんでした。
【研究の成果】
本研究ではまず、H+/K+イオンポンプ阻害剤として知られ、胃薬の主要成分としても使用されている、オメプラゾールを溶かした海水中でウニを受精させ飼育すると、その胚では原腸形成の際に原腸先端が胚の内部に深く陥入せず、植物極側の形状が細長くなり、さらに細胞分裂等により伸長した腸の大部分が胚の外部に露出した、「外腸胚」になることが見出されました(図1a)。そこでこの陥入が阻害される原因を探るため、原腸陥入を開始する直前の胚全体に対し、細胞の移動や変形の駆動力を生み出すFアクチンの蛍光顕微鏡観察を行いました。その結果、正常な胚では植物極側の各細胞内に、Fアクチン分布の強い細胞内Apical-basal極性が形成されるのに対し、オメプラゾール処理胚では外見上違いはないものの、各細胞内Fアクチン分布の極性が有意に弱くなっていることが見出されました(図1b)。そして、このFアクチン分布のApical-basal極性の強度に従って細胞の形状が変化すると仮定した数理モデルのシミュレーションによって、正常胚とオメプラゾール処理胚双方の胚の形状変化が再現されました(図1c)。またFアクチン重合・分解に関わる因子のノックアウト実験などから、このFアクチンの局在が、H+/K+イオンポンプに制御されている細胞内pHの細胞内極性に調節されていることも示唆されました。
【今後の展開】
「人生で最も大事な時は、誕生でもなく、結婚でもなく、死でもなく、原腸陥入である」(Lewis Wolpert, 1986)との言葉通り、原腸陥入はウニのみならず、ヒトを含む様々な動物の形態形成に普遍的で重要な過程であります。本研究ではその透明性により胚の内部まで直接観察が容易なウニに対し、原腸部分を確実に胚内部に陥入させる駆動力源とその制御機構を明らかにし、またそれらの不調による形態形成異常に関する知見を得ました。これらの知見は、観察が困難な様々な動物胚の原腸形成過程の駆動源を明らかにする基盤になると考えられます。また今回原腸陥入への関与が示唆されたH+/K+イオンポンプは、ウニや魚類・両生類・鳥類の体の左右非相称性を制御する因子としても知られています[1-3]。この本研究の知見から、H+/K+イオンポンプ活性が左右非相称性に繋がる機序は未だ不明ではありますが、このポンプの活性に起因する細胞内Fアクチン分布の極性形成が、胚の左右非相称な形態を生み出す細胞群の運動の駆動源にもなっている可能性も示唆されます。よって本研究成果は、原腸や左右軸の形成といった動物の形態の基礎工事を支える普遍的な性質の解明に、重要な手がかりを与えるものと期待されます。
用語解説
(注1)H+/K+イオンポンプ:細胞膜や細胞内脂質膜に貫通するように存在し、細胞内外、細胞内小器官内外のpHの調整を行うタンパク質。
(注2)Fアクチン:アクチンと呼ばれるタンパク質が重合し、繊維(filament)状に伸長した分子複合体構造。Fアクチン同士がミオシンなど他のタンパクを介してネットワーク状の超分子構造を形成し、アクチン重合による繊維の伸長やミオシンのスライディングによるネットワーク形状の変化を介して、細胞の形状変化を駆動する。
(注3)Apical-basal極性:細胞内の分子の、頂側膜(Apical)側から基底膜(Basal)側の方向に沿って生じる濃度差・濃度の極性。ウニ胚では、各細胞の胚の外側に沿った面がApical面、内側に沿った面がBasal面に対応している。
参考文献
[1] Duboc, V., Röttinger, E., Lapraz, F., Besnardeau, L., & Lepage, T. (2005). Left-right asymmetry in the sea urchin embryo is regulated by nodal signaling on the right side. Developmental Cell, 9(1), 147-158. https://doi.org/10.1016/j.devcel.2005.05.008
[2] Kawakami, Y., Raya, A., Raya, R. M., Rodríguez-Esteban, C., & Belmonte, J. C. I. (2005). Retinoic acid signalling links left–right asymmetric patterning and bilaterally symmetric somitogenesis in the zebrafish embryo. Nature, 435(7039), 165-171. https://doi.org/10.1038/nature03512
[3] Levin, M., Thorlin, T., Robinson, K. R., Nogi, T., & Mercola, M. (2002). Asymmetries in H+/K+-ATPase and cell membrane potentials comprise a very early step in left-right patterning. Cell, 111(1), 77-89. https://doi.org/10.1016/S0092-8674(02)00939-X
論文情報
- ●掲載誌:Genes to Cells
- ●論文タイトル:Partial exogastrulation due to apical-basal polarity of F-actin distribution disruption in sea urchin embryo by omeprazole.
- ●著者:Kaichi Watanabe1,*#, Yuhei Yasui1, Yuta Kurose2, Masashi Fujii1, Takashi Yamamoto1,3, Naoaki Sakamoto1,3,#, Akinori Awazu1,3,#
(*筆頭著者、#責任著者) - ●所属:1. 広島大学大学院統合生命科学研究科 2. 広島大学大学院理学研究科 3. 広島大学核内クロマチンライブダイナミクスの数理研究拠点
- ●DOI:http://doi.org/10.1111/gtc.12934






