
- EN
- JP

広島大学大学院医系科学研究科消化器・代謝内科学の内田宅郎研究員らの研究グループは、米国NIH(Dr. Jake Liang研究室)において、医療イノベーション共同研究講座 茶山一彰教授との共同研究により、塩基編集を用いて肝細胞にHBVレセプター(NTCP)のS267F遺伝子変異を導入することに成功し、編集した遺伝子改変細胞のHBV感染に対する機能を明らかにしました。
本研究成果は、12月10日に米国遺伝子細胞治療学会誌「Molecular Therapy—Methods & Clinical Development」の12月号に掲載されました。
【背景】
世界では約2億5千万人の人々がB型肝炎ウイルス(HBV)に感染しています。HBVは肝細胞表面に存在するSodium-dependent taurocholate co-transporting polypeptide(NTCP)をレセプターとして、肝細胞内に侵入し、核内に入ることで複製を開始します。
現在ではインターフェロン製剤と核酸アナログ製剤を用いることで、B型肝炎はウイルス増殖を抑え、肝疾患の進展を防ぐことが可能になっていますが、依然としてウイルスの排除は困難であり、新しい治療法の開発が望まれます。
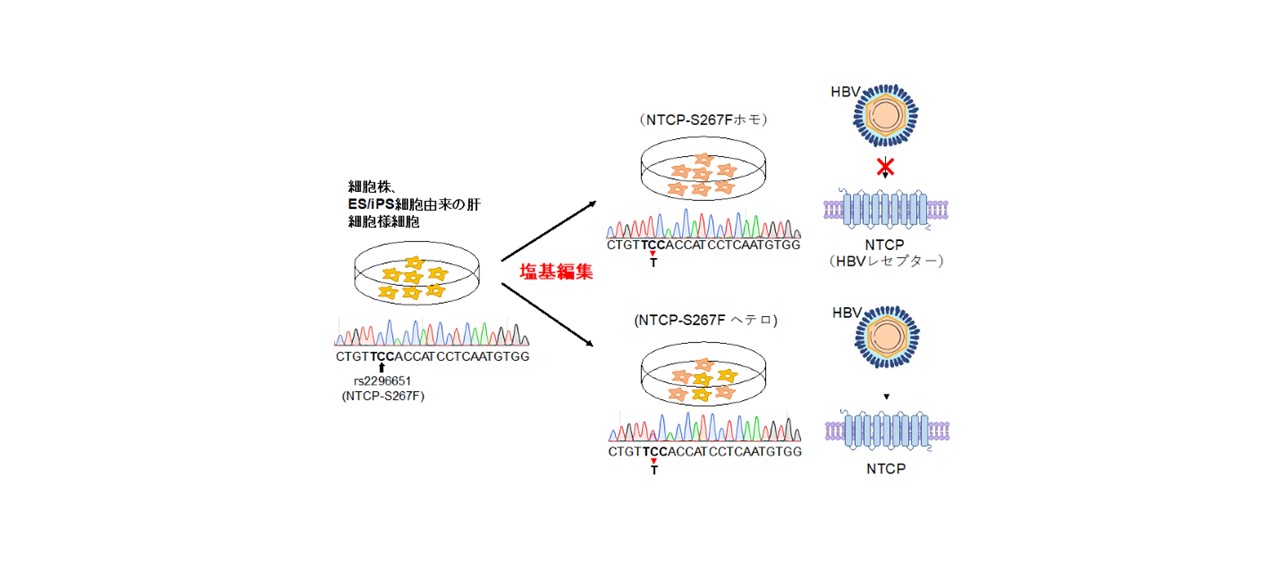
NTCPタンパク質をコードするSLC10A遺伝子の267番目のアミノ酸におけるセリン(S)からフェニルアラニン(F)への変異(NTCP-S267F変異)は、HBVの感染および肝炎の進行リスクの低下と関連することが報告されていますが、その機能は十分に評価されていませんでした。
ゲノム編集技術は、生物が持つ遺伝子のDNA配列を狙い通りに書き換えることができる画期的な技術です。従来のCRISPR/Cas9システムは遺伝子編集の手法として確立されたものですが、編集に先立って2本鎖DNAの切断(DSB)を必要としているため、編集時に遺伝子の欠失や挿入、転座などの予期せぬ編集が生じることが問題とされていました。
新規ゲノム編集技術である塩基編集(Base editing)はDSBを誘導せずに標的遺伝子の塩基を変換することができ、遺伝子変異を比較的簡単、かつ安全に導入することができます。
【研究成果の内容】
塩基編集により、NTCP-S267Fホモ接合型とヘテロ接合型の変異体を持つ細胞株を作製したところ、NTCPの発現自体には野生型と比べて変化は認めませんでした。一方で、HBVレセプターとしての機能には変化が見られ、NTCP-S267Fホモ接合体へはHBVは感染せず、ヘテロ接合体は野生型と同等の感染効率を示しました。
また、同様にES細胞・iPS細胞への塩基編集によりS267F変異体を作製し、肝細胞様細胞(HLC)に分化させたところ、遺伝子改変細胞においても、野生型と同様に高レベルの肝細胞分化マーカーを発現するHLCに分化しました。HLCにHBVを感染させると、ホモ接合型では感染は成立せず、ヘテロ接合型は野生型と同様にHBVに感染することを確認しました。
【今後の展開】
本研究成果は、将来的なHBV治療の新たな選択肢となる可能性を秘めています。さらに、塩基編集により作成された疾患モデルでは、遺伝子変異と病態形成のメカニズムをより生物学的に妥当なモデルで解析することが可能であり、B型肝炎のみならず、その他の疾患への応用も期待されます。
(※1)B型肝炎ウイルスのレセプター:
HBVは肝細胞の表面に存在するSodium-dependent taurocholate co-transporting polypeptide(NTCP)を介して肝細胞内に侵入し、核内に入ることで複製を開始します。